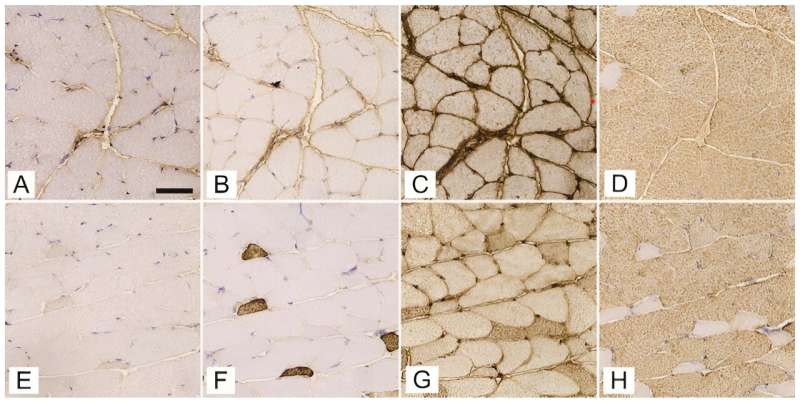
Expression der schweren Myosin-Ketten-Isoformen 1 (A, E), 2a (B, F), 2x/d (C, G) und 2b (D, H) in aufeinanderfolgenden Querschnitten des Gluteus maximuscle von Streptozotocin-induzierten diabetischen Mäusen (A–D) und altersentsprechende nicht-diabetische Mäuse (E–H). Der Maßstabsbalken zeigt 50 μm an. Kredit: Biomoleküle und Biomedizin (2023). DOI: 10.17305/bb.2023.9843
In einer aktuellen Studie des Instituts für Anatomie der Medizinischen Fakultät der Universität Ljubljana haben Forscher neue Erkenntnisse über die schädlichen Auswirkungen von Typ-1-Diabetes mellitus (T1DM) auf die Struktur der Skelettmuskulatur und die Kapillarnetzwerke geliefert. Diese umfassende Studie nutzt modernste 3D-Bildgebungstechnologie und stellt einen bedeutenden Fortschritt beim Verständnis der vielfältigen Auswirkungen von T1DM auf die Muskulatur des Körpers dar.
Diabetes mellitus stört die Regulierung des Glukosespiegels, was zu einem hohen Blutzuckerspiegel und einer Vielzahl damit verbundener Gesundheitsprobleme führt. T1DM, gekennzeichnet durch die immunvermittelte Zerstörung von insulinproduzierenden β-Zellen der Bauchspeicheldrüse, hat tiefgreifende Auswirkungen auf verschiedene Organe, insbesondere auf die Skelettmuskulatur, die eine entscheidende Rolle bei der Glukoseaufnahme und -regulierung spielt.
Diese Studie wurde in der Zeitschrift veröffentlicht Biomoleküle und BiomedizinZiel war es, die strukturellen und funktionellen Anpassungen der Skelettmuskulatur an die durch T1DM verursachten Stoffwechselstörungen zu untersuchen.
Die versteckten Veränderungen in Muskeln und Blutgefäßen
Die Forschung wurde an weiblichen C57BL/6J-OlaHsd-Mäusen unter Verwendung eines Streptozotocin (STZ)-induzierten Modells zur Simulation von T1DM durchgeführt und konzentrierte sich auf kritische Muskeln wie den Soleus, den Gluteus maximus und den Gastrocnemius. Die Forscher analysierten sorgfältig die Expression von Isoformen der schweren Myosinkette (MyHC) und die Feinheiten des 3D-Kapillarnetzwerks.
„Unsere Studie liefert ein tieferes Verständnis dafür, wie Typ-1-Diabetes nicht nur die Zusammensetzung der Muskelfasern beeinflusst, sondern auch die Kapillarnetzwerke, die für die Muskelgesundheit unerlässlich sind, erheblich verändert“, erklärte Nejc Umek, der Hauptautor der Studie.
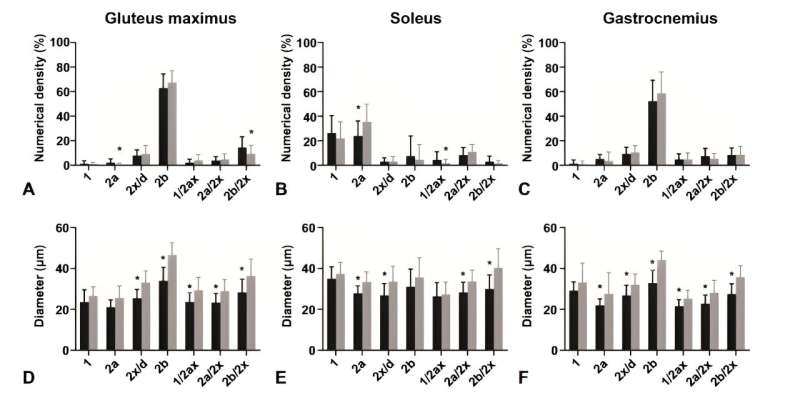
Numerische Dichte und Durchmesser der Muskelfasern (A,D) gluteus maximus, (B,E) soleus und (C,F) gastrocnemius. Vergleich zwischen Typ-1-Diabetes-mellitus-Mäusen (schwarze Säulen; n=12) und nicht-diabetischen Mäusen (graue Säulen; n=12). Die Daten werden als Mittelwert ± Standardabweichung dargestellt. *P<0,05. Bildnachweis: Bosnian Journal of Basic Medical Sciences
Die Untersuchung ergab, dass trotz gleichbleibender Zusammensetzung der schnell kontrahierenden Typ-2b-Fasern deutliche Unterschiede im Soleus-Muskel der diabetischen Mäuse beobachtet wurden, der einen verringerten Anteil an Typ-2a-Fasern und verringerte Faserdurchmesser in allen analysierten Muskeln aufwies.
Darüber hinaus wurde im Gluteus maximus von diabetischen Mäusen eine faszinierende Zunahme der Kapillarlänge pro Muskelvolumen entdeckt, was auf einen adaptiven Mechanismus zum Ausgleich der durch Diabetes verursachten Muskelfaseratrophie schließen lässt.
Methodische Fortschritte und wichtige Entdeckungen
Für die Studie wurden weibliche Mäuse verwendet und damit eine Lücke in der Diabetesforschung geschlossen, bei der geschlechtsspezifische Unterschiede beim Krankheitsverlauf und beim Ansprechen auf die Behandlung häufig außer Acht gelassen werden. Durch eine einzige intraperitoneale Verabreichung von STZ induzierten die Forscher erfolgreich T1DM, was durch deutlich erhöhte Nüchternglukosespiegel bestätigt wurde. Dieses Modell ermöglichte eine eingehende Untersuchung diabetesbedingter Veränderungen in einer kontrollierten Umgebung.
Durch den Einsatz von Antikörpern, die für verschiedene MyHC-Isoformen spezifisch sind, und modernster 3D-Bildgebung konnte das Team Veränderungen in den Muskelfasertypen und im Kapillarnetzwerk präzise quantifizieren. „Die von uns verwendeten fortschrittlichen 3D-Bildgebungstechniken stellen eine deutliche Verbesserung gegenüber herkömmlichen 2D-Analysen dar und bieten eine detailliertere und genauere Darstellung der Veränderungen des Kapillarnetzwerks im diabetischen Muskelgewebe“, erklärte Erika Cvetko, die leitende Autorin der Studie.
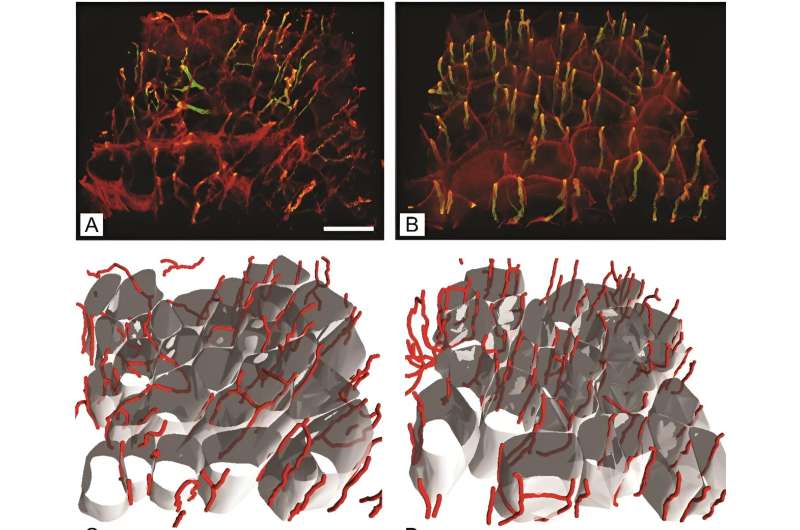
Kapillaren und Muskelfasern im Musculus gluteus maximus von Streptozotocin-induzierten diabetischen Mäusen (B, D) und altersentsprechenden nicht-diabetischen Mäusen (A, C). (A und B) Immunfluoreszenzfärbung mit Volumenwiedergabe von Kapillaren; (C und D) Rekonstruierte Muskelfasern mit versorgenden Kapillaren. Der Maßstabsbalken zeigt 50 μm an. Bildnachweis: Association of Basic Medical Sciences des FBIH
Auswirkungen auf das Diabetes-Management und zukünftige Richtungen
Die Ergebnisse dieser gemeinsamen Forschungsanstrengung unterstreichen die Notwendigkeit umfassender Diabetes-Managementpläne, die nicht nur die Glukoseregulierung, sondern auch den Erhalt der Muskelstruktur und -funktion umfassen. „Das Verständnis der spezifischen Veränderungen im Muskelgewebe aufgrund von Typ-1-Diabetes ebnet den Weg für die Entwicklung gezielter Therapien, die die Patientenergebnisse erheblich verbessern könnten“, fügte Cvetko hinzu.
Die Erkenntnisse der Studie über die erhöhte Kapillarlänge pro Muskelvolumen bei diabetischen Mäusen unterstreichen die möglichen kompensatorischen Reaktionen des Körpers auf die durch Diabetes verursachten strukturellen Veränderungen. Diese Erkenntnisse sind von entscheidender Bedeutung für die Entwicklung von Interventionen, die darauf abzielen, den Muskelabbau zu mildern und die allgemeine Diabetesversorgung zu verbessern.
Diese neuartige Studie trägt erheblich zum Wissensstand über Diabetes und seine systemischen Auswirkungen, insbesondere auf die Gesundheit der Skelettmuskulatur, bei. Indem die Forschung die entscheidende Rolle der Aufrechterhaltung der Muskelintegrität und der Gefäßversorgung bei der Behandlung von T1DM hervorhebt, eröffnet sie neue Wege für therapeutische Strategien und unterstreicht die Bedeutung multidisziplinärer Ansätze bei der Bewältigung dieser komplexen Krankheit.
Mehr Informationen:
Nejc Umek et al., Expression der schweren Kette von Myosin im Skelettmuskel und Veränderungen des 3D-Kapillarnetzwerks bei Streptozotocin-induzierten diabetischen weiblichen Mäusen, Biomoleküle und Biomedizin (2023). DOI: 10.17305/bb.2023.9843
Bereitgestellt von der Association of Basic Medical Sciences des FBIH
Zitat: Wie verändert Typ-1-Diabetes die Muskelstruktur und die Blutversorgung? (2024, 8. Februar), abgerufen am 8. Februar 2024 von https://medicalxpress.com/news/2024-02-diabetes-muscle-blood.html
Dieses Dokument unterliegt dem Urheberrecht. Abgesehen von einem fairen Handel zum Zweck des privaten Studiums oder der Forschung darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient ausschließlich Informationszwecken.
