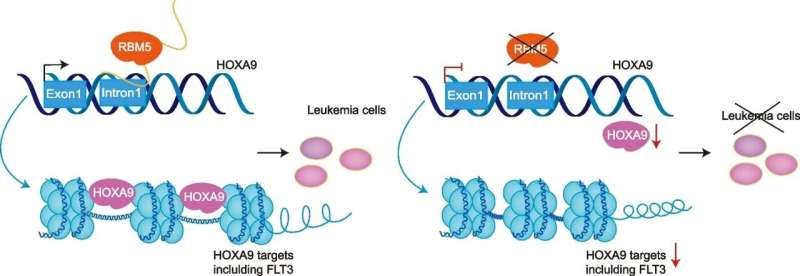
Modell für die neue Regulierungsachse RBM5-HOXA9 in AML. RBM5 reguliert direkt die Transkriptionsaktivität des HOXA9-Locus, der die ordnungsgemäße Downstream-Signaltransduktion aufrechterhält, einschließlich der FLT3-responsiven Ziele in Zellen der akuten myeloischen Leukämie. Kredit: Genombiologie (2024). DOI: 10.1186/s13059-023-03149-8
Das Protein HOXA9 wird in den meisten Fällen von akuter myeloischer Leukämie (AML) überexprimiert und ist mit schlechten Behandlungsergebnissen verbunden. Allerdings ist HOXA9 ein therapeutisch schwer zu bekämpfendes Protein, weshalb Forscher am St. Jude Children's Research Hospital nach Möglichkeiten suchten, es indirekt auszulöschen.
Mithilfe des CRISPR/Cas9-Screenings identifizierten die Forscher RBM5 und zeigten einen ursächlichen Zusammenhang zwischen der RBM5-Expression und der Proliferation von Leukämiezellen. Diese Verbindung wird durch eine neuartige Doppelfunktion von RBM5 als DNA- und RNA-Handler bei der Genexpression vorangetrieben. Die Studie wurde heute in veröffentlicht Genombiologie.
Die Überexpression des Proteins HOXA9 ist ein Kennzeichen von AML und tritt in über 70 % der Fälle auf, oft mit schlechter Prognose. Während dies darauf schließen lässt, dass es sich um ein nützliches Angriffsziel für Medikamente handelt, ist das Protein aufgrund seiner Rolle als Transkriptionsfaktor „nicht medikamentös einsetzbar“, da ein Medikament, das HOXA9 stört, wahrscheinlich zahlreiche andere Effekte außerhalb des Ziels haben würde.
Dies inspirierte Forscher dazu, das Problem anders anzugehen, indem sie die Proteine untersuchten, mit denen HOXA9 zusammenarbeitet und auf die es für seine Funktion angewiesen ist. Chunliang Li, Ph.D., St. Jude Department of Tumor Cell Biology, Mitautor dieses Artikels, ist einer dieser Forscher. Durch seine jüngste Arbeit, bei der er eine unvoreingenommene CRISPR-Screening-Strategie zur Identifizierung von Zielen von HOXA9 entwickelte, entdeckte er ein Netzwerk von Möglichkeiten.
„Seit der Gründung meines Labors im Jahr 2017 war dies eine kontinuierliche Anstrengung“, sagte Li. „Anfang 2019 haben wir dieses einzigartige Reportersystem aufgebaut, das der erste Reporter ist, der die HOXA9-Expression in diesen Leukämiesystemen authentisch darstellt.“
Der CRISPR/Cas9-Screening-Ansatz ist elegant schlicht im Design, aber unglaublich effektiv. Dabei wird eine fluoreszierende Markierung an das HOXA9-Gen angehängt und in Leukämie-Zelllinien eingefügt. Dies ermöglicht es Forschern, Unterschiede in den Expressionsniveaus zu verfolgen, indem sie die Fluoreszenz in Zellen betrachten.
„Wir wollten einen zielgerichteteren oder neuartigen Regulator identifizieren. Deshalb führten wir ein unvoreingenommenes CRISPR-Screening des gesamten Genoms durch, um auf alle in Zellen exprimierten Gene abzuzielen“, erklärte Li. Dadurch konnten die Forscher verschiedene Wege untersuchen, auf denen HOXA9 seinen fluoreszierenden Fingerabdruck hinterließ.
Zur Überraschung der Forscher schienen Spleißfaktoren der am häufigsten vertretene Signalweg zu sein.
„Das war für uns ziemlich überraschend, da Spleißfaktoren verschiedene Kombinationen des Transkripts regulieren, normalerweise jedoch nicht die Menge. Unsere Daten legen nahe, dass diese Proteine die HOXA9-Expressionsmenge steuern“, sagte Li. „Also haben wir die Hypothese aufgestellt, dass die Spleißfaktoren möglicherweise eine andere Funktion haben, etwa eine Doppelfunktion.“
Das hervorstechende Protein war das RNA-bindende Protein RBM5. Die Forscher fanden heraus, dass RBM5 in Leukämiezellen im Gegensatz zu anderen Zelltypen stark exprimiert wird und dass sowohl die DNA- als auch die RNA-Bindungsstellen für seine onkogenen Funktionen von entscheidender Bedeutung sind. Während die RBM-Familie lebenswichtige RNA-Spleißfaktoren umfasst, war ihre Funktion bei der DNA-Transkription unbekannt. Um die direkte Transkriptionsregulation von RBM5/HOXA9 anzugehen, entwickelten die Forscher ein System, das den akuten Abbau von RBM5 ermöglicht.
„Unmittelbar nach der Entfernung des RBM5-Proteins aus den Zellen wurden die HOXA9-mRNA-Spiegel deutlich reduziert“, erklärte Li. „Diese Reduzierung erfolgte bereits zwei Stunden später, hatte jedoch keinen Einfluss auf die Spleißereignisse von HOXA9.“ Darüber hinaus wurden Leukämiezellen, denen die Fähigkeit zur Produktion von RBM5 entzogen war, durch Überexpression von HOXA9 gerettet, was den Zusammenhang zwischen den beiden Proteinen weiter demonstriert.
Aufgrund dieser Ergebnisse möchte Li das Protein als Wirkstoffziel zur Behandlung von AML erforschen.
„Wir glauben, dass RBM5 ein sehr gutes Abhängigkeitsgen ist, das basierend auf unseren Funktionstests ein gutes Ziel sein sollte“, sagte er. „Wenn wir gezielt auf die DNA-Bindungsaffinität dieser Proteine abzielen können, sollten wir in der Lage sein, sie synergetisch mit anderen bestehenden Therapien zu kombinieren, um HOXA9-bedingte Leukämie zu bekämpfen.“
Mehr Informationen:
Mengli Zhang et al., Das RNA-bindende Protein RBM5 spielt eine wesentliche Rolle bei akuter myeloischer Leukämie, indem es das onkogene Protein HOXA9 aktiviert. Genombiologie (2024). DOI: 10.1186/s13059-023-03149-8
Bereitgestellt vom St. Jude Children's Research Hospital
Zitat: HOXA9-Tracking zeigt Doppelfunktion und therapeutisches Potenzial von RBM5 bei akuter myeloischer Leukämie (2024, 12. Januar), abgerufen am 13. Januar 2024 von https://medicalxpress.com/news/2024-01-hoxa9-tracking-reveals-rbm5-dual.html
Dieses Dokument unterliegt dem Urheberrecht. Abgesehen von einem fairen Handel zum Zweck des privaten Studiums oder der Forschung darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient ausschließlich Informationszwecken.
