Grafische Zusammenfassung. Kredit: Zellberichte (2024). DOI: 10.1016/j.celrep.2023.113652
In einer online veröffentlichten Studie in Zellberichte Forscher erstellen ein Zebrafischmodell für die In-vivo-Markierung von Gehirnperizyten und erforschen systematisch die Entwicklungsdynamik von Gehirnperizyten im frühen Embryonalstadium.
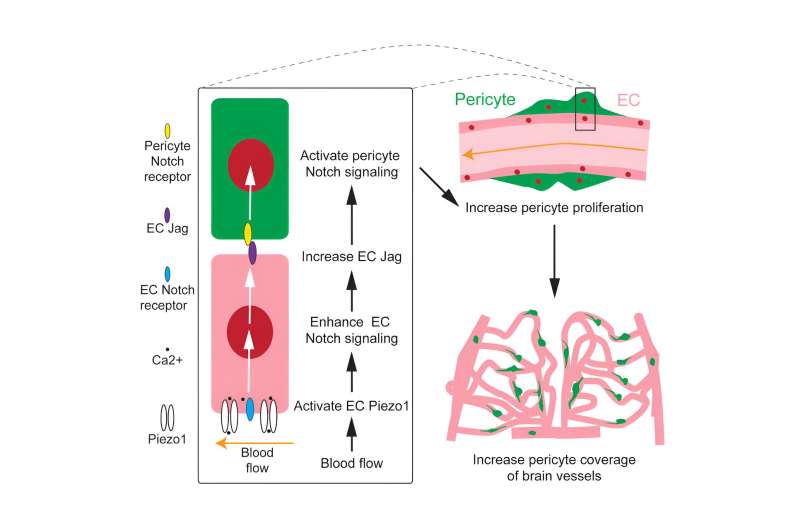
Unter der Leitung von Du Jiulin am Institute of Neuroscience, Centre for Excellence in Brain Science and Intelligence Technology der Chinesischen Akademie der Wissenschaften, enthüllen sie die fördernde Wirkung des Blutflusses auf die Proliferation von Perizyten nach dem Eindringen in das Gehirn und klären diesen Prozess auf beruht auf der Aktivierung des mechanosensitiven Ionenkanals Piezo1 in vaskulären Endothelzellen (ECs) und seiner nachgeschalteten Notch-Signalisierung.
Die Gehirnfunktion ist auf ein komplexes und effektives Gefäßnetzwerk angewiesen, das die notwendigen Nährstoffe bereitstellt und Abfallprodukte abtransportiert. Um die Homöostase des Nervengewebes und die normale Nervenaktivität aufrechtzuerhalten, bildet das Gehirngefäßsystem während der Entwicklung die Blut-Hirn-Schranke (BBB), die den Stoffaustausch zwischen Blut und Gehirnparenchym streng kontrolliert. Störungen der Blut-Hirn-Schranke stehen in engem Zusammenhang mit verschiedenen Erkrankungen des Gehirns, beispielsweise der Alzheimer-Krankheit.
Perizyten spielen als Wandzellen, die fest an der Außenseite der EC-Röhren in Kapillaren befestigt sind, eine entscheidende Rolle bei der Aufrechterhaltung der Integrität der Blut-Hirn-Schranke. Daher ist das Verständnis des Entwicklungsprozesses von Gehirnperizyten für die Untersuchung der Bildung und Aufrechterhaltung der BHS von entscheidender Bedeutung.
Frühere Untersuchungen haben gezeigt, dass der Blutfluss, das wichtigste funktionelle Verhalten von Blutgefäßen, an der Regulierung der Entwicklung von Gehirn-ECs beteiligt ist. Ob der Blutfluss jedoch das Wachstum von Gehirnperizyten beeinflusst, blieb eine unerforschte Frage.
Um die dynamische Entwicklung von Gehirnperizyten zu beobachten, verwendeten die Forscher Zebrafische als Wirbeltiermodell und erstellten mithilfe von CRISPR/Cas9-Genbearbeitungstechniken ein In-vivo-Modell mit spezifisch markierten Perizyten. Die Ergebnisse der Langzeit-Zeitraffer-Bildgebung zeigten, dass Gehirnperizyten früh aus den Vorläuferzellen auf perizerebralen Blutgefäßen entstehen und ihre Population nach dem Eindringen in das Gehirn hauptsächlich durch Proliferation ausdehnt.
Durch die pharmakologische Veränderung der Blutflussgeschwindigkeiten fanden Forscher heraus, dass der Blutfluss die Perizytenbedeckung der Gehirngefäße hochreguliert, was hauptsächlich durch die Förderung der Proliferation von Gehirnperizyten erreicht wird.
Darüber hinaus entdeckten die Forscher, dass der mechanosensitive Ionenkanal Piezo1, der auf ECs exprimiert wird, die Veränderungen im Blutfluss erkennt und die Wirkung des Blutflusses auf die Perizytenproliferation vermittelt.
Wie wird der Einfluss des Blutflusses von ECs auf Perizyten übertragen? Forscher beobachteten, dass die Aktivierung von Piezo1 die Aktivität der Notch-Signalisierung in ECs deutlich steigerte. Eine spezifische Verstärkung oder Hemmung des Notch-Signals in ECs führte zu einer entsprechenden Hoch- oder Herunterregulierung der Proliferationsfrequenz von Gehirnperizyten.
Eine Erhöhung des Blutflusses oder der Piezo1-Aktivität führte nicht zu einer signifikanten Veränderung der Perizytenbedeckung der Gehirngefäße, wenn die EC-Notch-Signalisierung unterdrückt wurde.
Die Ergebnisse legen nahe, dass EC-intrinsische Notch-Signale die Regulierung des Blutflusses bei der Entwicklung von Gehirnperizyten vermitteln, da sie Piezo1 nachgeschaltet sind. Darüber hinaus lieferten die Forscher durch die gezielte Verstärkung oder Hemmung der nach außen gerichteten Übertragung des Notch-Signals in ECs den Beweis, dass die ECs mit verstärktem Notch-Signal die Notch-Signalisierung in Perizyten direkt aktivierten und deren Teilung förderten.
Diese Studie deckt einen neuartigen Regulierungsmechanismus für die Blutflussregulierung der Hirngefäßentwicklung auf und bietet neue Perspektiven für das Verständnis der Hirnperizytenentwicklung.
Für Forscher, die aktiv nach Methoden zur Behandlung neurologischer Störungen suchen, könnte es neue Therapiestrategien bieten. Beispielsweise fördert die Hochregulierung der Aktivität von Piezo1 oder der Intensität des Notch-Signals in ECs die Proliferation von Gehirnperizyten, verbessert die Funktion von Gehirngefäßen und erleichtert die Wiederherstellung der Gehirnfunktion bei Patienten mit Krankheiten wie Alzheimer, vaskulärer Demenz usw Schlaganfall.
Mehr Informationen:
Huaxing Zi et al., Piezo1-abhängige Regulierung der Perizytenproliferation durch Blutfluss während der Entwicklung der Hirngefäße, Zellberichte (2024). DOI: 10.1016/j.celrep.2023.113652
Zur Verfügung gestellt von der Chinesischen Akademie der Wissenschaften
Zitat: Forscher entdecken Blutflussregulation bei der Entwicklung von Gehirnperizyten (2024, 9. Januar), abgerufen am 9. Januar 2024 von https://medicalxpress.com/news/2024-01-uncover-blood-brain-pericyte.html
Dieses Dokument unterliegt dem Urheberrecht. Abgesehen von einem fairen Handel zum Zweck des privaten Studiums oder der Forschung darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient ausschließlich Informationszwecken.
