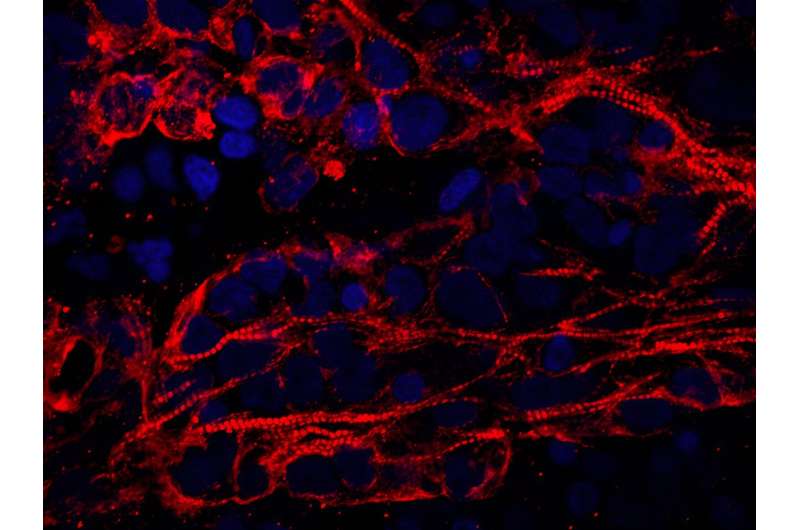
Konfokales Bild mit hoher Vergrößerung von Kardiomyozyten im Myokardgewebe eines Organoids. Beachten Sie die gebänderte Struktur der Sarkomere (der kontrahierenden Einheiten des Herzens). Rot: Kardiomyozyten, Blau: Zellkerne. Bildnachweis: Aleksandra Kostina, Ph.D.
Ein fortschrittliches Organoidsystem des menschlichen Herzens kann verwendet werden, um die Entwicklung des embryonalen Herzens unter prägestationalen Diabetes-ähnlichen Bedingungen zu modellieren, berichten Forscher in der Zeitschrift Stammzellberichte.
Die Organoide rekapitulieren Merkmale einer durch Schwangerschaftsdiabetes verursachten angeborenen Herzkrankheit, die bei Mäusen und Menschen auftritt. Die Ergebnisse zeigten auch, dass Stress im endoplasmatischen Retikulum (ER) und Lipidungleichgewicht kritische Faktoren sind, die zu diesen Störungen beitragen, die durch die Exposition gegenüber Omega-3-Fettsäuren gelindert werden könnten.
„Die eingesetzte neue stammzellbasierte Organoid-Technologie wird physiologisch relevante Studien am Menschen ermöglichen und es uns ermöglichen, Tiermodelle zu umgehen und mehr Informationen über relevante Krankheitsmechanismen zu erhalten, was die Entdeckung von Arzneimitteln und die medizinische Übersetzung beschleunigt“, sagt der leitende Studienautor Aitor Aguirre vom Bundesstaat Michigan Universität.
Angeborene Herzfehler sind die häufigste Art angeborener Defekte beim Menschen. Prägestationsdiabetes – Diabetes, der die Mutter vor und während des ersten Trimesters der Schwangerschaft betrifft – ist ein wichtiger Faktor, der zu angeborenen Herzfehlern führt und bei einer bedeutenden, wachsenden Population diabetischer Patientinnen im gebärfähigen Alter auftritt.
Neugeborene von Müttern mit prägestationalem Diabetes können ein bis zu 12-fach erhöhtes Risiko für angeborene Herzfehler haben. Leider ist prägestationaler Diabetes aufgrund der Empfindlichkeit des sich entwickelnden Embryos gegenüber Glukoseschwankungen klinisch schwer zu behandeln und stellt ein schwerwiegendes Gesundheitsproblem für Mutter und Fötus dar.
Der begrenzte Zugang zu menschlichem Gewebe für die Erforschung von Krankheiten im Frühstadium hat zu einer übermäßigen Abhängigkeit von Tiermodellen geführt. Es bleibt jedoch unklar, inwieweit Nagetiermodelle die beim Menschen vorhandenen Anomalien rekapitulieren, da kritische Artenunterschiede in der Herzgröße, Herzphysiologie, Elektrophysiologie und Bioenergetik vorliegen.
Darüber hinaus basieren Nagetiermodelle und viele In-vitro-Zellmodelle auf aggressiven diabetischen Erkrankungen, was zu übertriebenen Merkmalen führt, die möglicherweise nicht klinisch relevant sind.
„Fortschritte in der Biotechnologie und im Bioingenieurwesen ermöglichen die Schaffung menschlicher Miniorgane in vitro“, sagt Aguirre. „Mit diesen Mini-Organen lassen sich menschliche Krankheiten derzeit viel besser verstehen, ohne die Nachteile von Tiermodellen.“
In der neuen Studie verwendeten Aguirre und sein Team ein fortschrittliches Herz-Organoidmodell, das aus menschlichen pluripotenten Stammzellen gewonnen wurde. Dieses Modell rekapituliert die Entwicklung des menschlichen Herzens während des ersten Trimesters, einschließlich kritischer Schritte wie Kammerbildung, Vaskularisierung, Organisation des Herzgewebes und relevanter Herzzelltypen.
Um die Auswirkungen von prägestationalem Diabetes gezielt zu modellieren, veränderten die Forscher die Kulturbedingungen, um die gemeldeten physiologischen Glukose- und Insulinspiegel der Patienten genau widerzuspiegeln.
Die resultierenden prägestationalen Diabetes-Herzorganoide (PGDHOs) entwickelten Merkmale, die in früheren Studien an Mäusen und Menschen beobachtet wurden. Beispielsweise waren die Organoide des menschlichen Herzens von Diabetikern größer, was auf Anzeichen einer Herzhypertrophie hindeutet – ein erstes Anzeichen für mütterlichen Schwangerschaftsdiabetes. Diese Beobachtung wurde durch die Untersuchung der Kardiomyozytengröße bestätigt.
Die PGDHOs zeigten auch Arrhythmien und eine Verringerung der Schlagfrequenz, was bei neugeborenen Ratten von diabetischen Müttern beobachtet wurde. Darüber hinaus ergab die transkriptomische Einzelzellanalyse von PGDHOs eine Verringerung der Kardiomyozytenzahl, eine signifikante Gewebeausdehnung an der Außenfläche des Herzens und das Fehlen eines gut entwickelten Gefäßsystems in frühen Entwicklungsstadien.
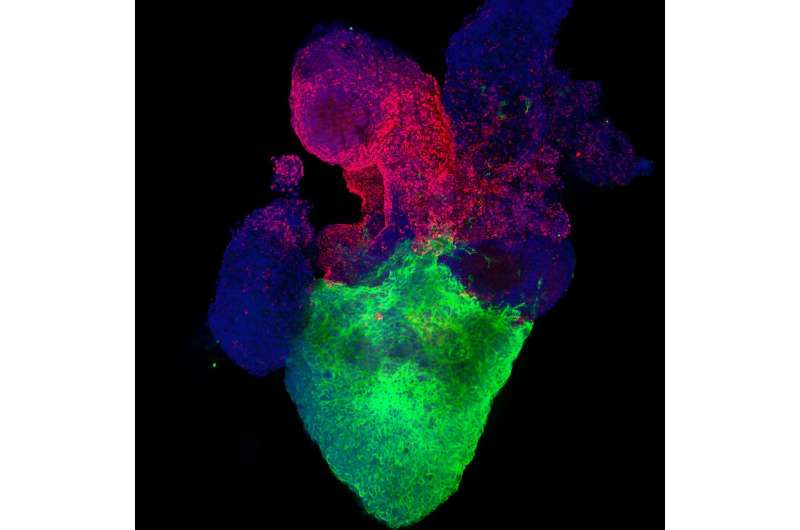
Dies zeigt ein Gesamtbild eines Organoids mit einer ventrikelartigen Struktur unten (rot: Kardiomyozyten) und einer proepikardialen Struktur oben (grün: WT1). Bildnachweis: Aleksandra Kostina, Ph.D.
Die PGDHOs zeigten auch eine erhöhte Anreicherung reaktiver Sauerstoffspezies (ROS), was einen erhöhten oxidativen Stress und eine mitochondriale Schwellung aufzeigte – ebenfalls Kennzeichen diabetischer embryonaler Herzerkrankungen.
Ein erheblicher Teil der ROS war im ER lokalisiert und könnte dessen Funktion beeinträchtigen, was zu einem Zustand führt, der als ER-Stress bekannt ist. Darüber hinaus zeigten die PGDHOs ein deutliches Ungleichgewicht bei sehr langkettigen Fettsäuren, insbesondere bei mehrfach ungesättigten Omega-3-Fettsäuren, die größtenteils im ER synthetisiert werden.
Zusammengenommen deuten diese Ergebnisse auf ein großes ER-induziertes Lipid-Ungleichgewicht bei PGDHOs hin. Dieses Ungleichgewicht hängt mit dem Abbau von Fettsäure-Desaturase 2 (FADS2) – einem wichtigen Enzym der Lipidbiosynthese im ER – durch den IRE1-abhängigen mRNA-Zerfallsweg (RIDD) zusammen, der mit mehreren anderen Herzerkrankungen in Zusammenhang steht.
Um die Auswirkungen von ER-Stress zu beheben, testeten die Forscher mehrere potenziell therapeutische Verbindungen auf PGDHOs. Eine Mischung aus Omega-3-Fettsäuren verbesserte die diabetischen Symptome, während sie auf das Inositol-benötigende Enzym 1 (IRE1) abzielte und die Hypertrophie der Kardiomyozyten reduzierte. Alle Verbindungen stellten auch die FADS2-Werte wieder her.
„Den Organoiden fehlen noch einige Merkmale, die wichtig sein könnten, wie etwa die äußere Vaskularisierung und der Ausflusstrakt sowie eine bessere Kammerbildung, sodass uns möglicherweise immer noch wichtige Aspekte angeborener Herzfehler und diabetischer Kardiomyopathie fehlen“, sagt Aguirre.
„Einerseits möchten wir mit Klinikern zusammenarbeiten, um die Wirksamkeit und Sicherheit unserer Ergebnisse bei schwangeren Frauen zu ermitteln. Andererseits möchten wir unser Organoidmodell auf andere Erkrankungen anwenden, die angeborene Herzfehler betreffen, damit wir das Leben von Frauen verbessern können diese Kinder in der Zukunft.“
Mehr Informationen:
ER-Stress und Lipidungleichgewicht treiben diabetische embryonale Kardiomyopathie in einem Organoidmodell der menschlichen Herzentwicklung voran, Stammzellberichte (2024). DOI: 10.1016/j.stemcr.2024.01.003. www.cell.com/stem-cell-reports … 2213-6711(24)00006-7
Zitat: Herzorganoide simulieren eine durch prägestationalen Diabetes verursachte angeborene Herzkrankheit (2024, 8. Februar), abgerufen am 8. Februar 2024 von https://medicalxpress.com/news/2024-02-heart-organoids-simulate-pregestational-diabetes.html
Dieses Dokument unterliegt dem Urheberrecht. Abgesehen von einem fairen Handel zum Zweck des privaten Studiums oder der Forschung darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient ausschließlich Informationszwecken.
